

2.1. Кислоты серная и соляная, растворы молярных концентраций: 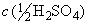 и
и 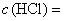 1 моль/дм
1 моль/дм; 0,5 моль/дм
и 0,1 моль/дм
Формула |
Формула |
|||
Относительная молекулярная масса - 98,07 |
Относительная молекулярная масса - 36,46 |
|||
Молярная масса эквивалента - 49,04 г/моль |
Молярная масса эквивалента - 36,46 г/моль |
|||
2.1.1. Реактивы и растворы
Вода дистиллированная по ГОСТ 6709.
Барий хлористый по ГОСТ 4108, раствор массовой долей 20%.
Кислота серная по ГОСТ 4204.
Кислота соляная по ГОСТ 3118, концентрированная и растворы концентраций: 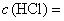 0,1 моль/дм
0,1 моль/дм (0,1 н.) и 0,01 моль/дм
(0,01 н.).
Фенолфталеин (индикатор) по ТУ 6-09-5360*, спиртовой раствор с массовой долей 0,1%.
________________
* Документ в информационных продуктах не содержится. За информацией о документе Вы можете обратиться в Службу поддержки пользователей. - Примечание изготовителя базы данных.
Метиловый оранжевый (индикатор) по ТУ 6-09-5171, раствор с массовой долей 0,1%.
Метиловый красный (индикатор) по ТУ 6-09-5169, спиртовой раствор с массовой долей 0,1%.
Смешанный кислотно-основной индикатор (метиловый красный и метиленовый голубой).
Натрия бромид по ТУ 6-09-5331.
Натрий тетраборнокислый 10-водный по ГОСТ 4199, препарат с массовой долей основного вещества (100,0±0,2)%, готовят по п.2.1.1.1.
Натрий хлористый по ГОСТ 4233.
Натрий углекислый по ГОСТ 83, предварительно прокаленный; готовят по п.2.1.1.2.
Поглотитель химический известковый ХП-И по ГОСТ 6755 или известь натронная.
Спирт этиловый ректификованный технический по ГОСТ 18300.
2.1.1.1. Приготовление 10-водного тетраборнокислого натрия
Для получения препарата, точно отвечающего формуле 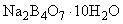 , 100 г препарата растворяют в 550 см
, 100 г препарата растворяют в 550 см воды при 50-60 °C (при более высокой температуре кристаллизуется
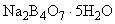 ). Раствор фильтруют, охлаждают до 25-30 °C и энергично перемешивают. При этом происходит кристаллизация 10-водного тетраборнокислого натрия. Образующиеся кристаллы отфильтровывают и вторично подвергают кристаллизации в тех же условиях. Затем кристаллы высушивают между листами фильтровальной бумаги, помещают тонким слоем в чашку Петри и доводят до постоянной массы, выдерживая в эксикаторе над смоченными водой кристаллами бромида натрия. Кристаллы 10-водного тетраборнокислого натрия сохраняют в стаканчике для взвешивания (ГОСТ 25336) в том же эксикаторе при тех же условиях.
). Раствор фильтруют, охлаждают до 25-30 °C и энергично перемешивают. При этом происходит кристаллизация 10-водного тетраборнокислого натрия. Образующиеся кристаллы отфильтровывают и вторично подвергают кристаллизации в тех же условиях. Затем кристаллы высушивают между листами фильтровальной бумаги, помещают тонким слоем в чашку Петри и доводят до постоянной массы, выдерживая в эксикаторе над смоченными водой кристаллами бромида натрия. Кристаллы 10-водного тетраборнокислого натрия сохраняют в стаканчике для взвешивания (ГОСТ 25336) в том же эксикаторе при тех же условиях.
Массовую долю воды определяют следующим образом: 10,00 г препарата, перекристаллизованного и доведенного до постоянной массы, высушивают в платиновом тигле (ГОСТ 6563) сначала на водяной бане, затем на песчаной бане или в сушильном шкафу (примерно 200 °C), после этого - в муфельной печи при 700-800 °C до постоянной массы (результат взвешивания записывают в граммах до третьего десятичного знака), что составляет 0,01% избытка или недостатка влаги).
2.1.1.2. Приготовление безводного углекислого натрия
Углекислый натрий прокаливают при 270-300 °C до постоянной массы в день установки титра. Для этого некоторое количество препарата в платиновом тигле с крышкой помещают на песчаную баню так, чтобы уровень песка снаружи был не ниже уровня препарата в тигле. Термометр помещают в песок около тигля, причем резервуар со ртутью термометра должен находиться на уровне препарата в тигле. Баню нагревают постепенно до 270-300 °C, препарат выдерживают при этой температуре около 2 ч, периодически перемешивая платиновым шпателем и тщательно следя за тем, чтобы температура не поднималась свыше 300 °C. Прокаливание допускается проводить в высокотемпературном электрическом шкафу с регулируемой температурой. После охлаждения препарат взвешивают и повторяют прокаливание до достижения постоянной массы.
Для контроля полноты прокаливания навеску 0,15-0,25 г прокаленного препарата растворяют в воде, прибавляют 5-7 г хлористого натрия, охлаждают до 0 °C, прибавляют 2-3 капли раствора фенолфталеина и титруют из бюретки 1(2)-2-50-0,1 (ГОСТ 29251) раствором соляной кислоты 0,1 моль/дм до обесцвечивания раствора. Замечают показания бюретки ("
" см
), затем прибавляют 1 каплю раствора метилового оранжевого, продолжают титрование до перехода желтой окраски раствора в розовую и замечают показания бюретки от начала титрования ("
" см
). Если отношение
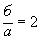 , прокаливание считают законченным. Если отношение
, прокаливание считают законченным. Если отношение 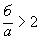 (т.е. не весь бикарбонат превратился в карбонат), прокаливание продолжают.
(т.е. не весь бикарбонат превратился в карбонат), прокаливание продолжают.
Прокаленный препарат переносят в банку с пришлифованной пробкой и сохраняют в эксикаторе с известковым химическим поглотителем ХП-И. Массовая доля основного вещества должна быть (100±0,2)%.
Массовую долю гидроокиси натрия в углекислом натрии определяют следующим образом: 30 см воды помещают в коническую колбу Кн-1-100-14/23 ТХС (ГОСТ 25336) и кипятят в течение 2 мин. Затем прибавляют 2 г анализируемого углекислого натрия и закрывают колбу пробкой, в которую вставлена трубка с известковым химическим поглотителем ХП-И. Сразу после растворения соли к горячему раствору приливают 25 см
раствора хлористого бария и две капли раствора фенолфталеина. После этого колбу закрывают той же пробкой, взбалтывают и охлаждают. Если раствор окрасится, его титруют из бюретки 6-2-2(5) или 7-2-3(10) (ГОСТ 29251) до обесцвечивания раствором соляной кислоты 0,01 моль/дм
. На титрование должно расходоваться не более 1 см
раствора соляной кислоты, что соответствует массовой доле гидроокиси натрия 0,02%.
2.1.2. Приготовление растворов кислот.
Растворы кислот готовят разбавлением соответствующих концентрированных кислот. Для приготовления 1 дм раствора берут объемы серной и соляной кислоты, указанные в табл.1, 2.
Таблица 1
Плотность серной кислоты |
Объем концентрированной серной кислоты, необходимый для приготовления |
||
|
|
|
|
1,830 |
29,0 |
14,5 |
2,9 |
1,835 |
28,6 |
14,3 |
2,8 |
Таблица 2
Плотность соляной кислоты |
Объем концентрированной соляной кислоты, необходимый для приготовления |
||
|
|
|
|
1,174 |
90,0 |
45,0 |
9,0 |
1,188 |
85,0 |
42,5 |
8,5 |
Отмеренный объем кислоты осторожно при перемешивании вливают в воду и доводят объем раствора водой до 1 дм.
2.1-2.1.2. (Измененная редакция, Изм. N 1).
2.1.3. Определение коэффициента поправки
2.1.3.1. Определение коэффициента поправки по безводному углекислому натрию
Формула 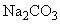 .
.
Относительная молекулярная масса - 105,99.
Молярная масса эквивалента - 53,00 г/моль.
В зависимости от молярной концентрации приготовленного раствора кислоты навески безводного углекислого натрия взвешивают в закрытом стаканчике для взвешивания в соответствии с табл.3.
Таблица 3
Заданная молярная концентрация титрованных растворов |
Масса навески |
||||
серной кислоты |
соляной кислоты |
||||
|
|
От |
1,6000 |
до |
2,1000 |
|
|
" |
0,8000 |
" |
1,0000 |
|
|
" |
0,1600 |
" |
0,2100 |
Навеску помещают в коническую колбу, прибавляют 40 см воды, добавляют 3-4 капли раствора смешанного индикатора и титруют из бюретки раствором кислоты до перехода зеленой окраски раствора в красно-фиолетовую (для растворов массовой концентрации 0,1 моль/дм
переход наблюдается на фоне молочного стекла).
Затем раствор нагревают, кипятят 2-3 мин для удаления углекислоты и после охлаждения продолжают титрование до перехода вновь появившейся окраски раствора в красно-фиолетовую.
Допускается применять в качестве индикатора метиловый оранжевый, при этом окраска раствора переходит из желтой в оранжевую.
2.1.3.2. Определение коэффициента поправки по 10-водному тетраборнокислому натрию (для раствора молярной концентрации 0,1 моль/дм)
Формула 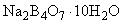 .
.
Относительная молекулярная масса - 381,37.
Молярная масса эквивалента - 190,68 г/моль.
0,6000-0,8000 г 10-водного тетраборнокислого натрия помещают в коническую колбу, растворяют при энергичном взбалтывании в 30-60 см теплой (50-60 °С) воды, охлаждают до комнатной температуры, добавляют 3-4 капли раствора метилового красного и титруют из бюретки раствором серной или соляной кислоты концентрации 0,1 моль/дм
до перехода желтой окраски в розовато-оранжевую.
2.1.3.1; 2.1.3.2. (Измененная редакция, Изм. N 1).
2.1.3.3. (Исключен, Изм. N 1).
2.1.4. Растворы кислот, которые хранятся продолжительное время, могут увеличивать свою молярную концентрацию за счет испарения воды. При наличии на стенках склянки с тубусом или бутылки капель воды раствор перед применением необходимо взбалтывать.
2.2. Натрия гидроокись, растворы молярных концентраций: 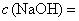 1 моль/дм
1 моль/дм, 0,5 моль/дм
и 0,1 моль/дм
Формула 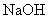 .
.
Относительная молекулярная масса - 40,00.
Молярная масса эквивалента - 40,00 г/моль.
2.2.1. Реактивы и растворы
Вода дистиллированная по ГОСТ 6709.
Калий йодноватокислый по ГОСТ 8504, препарат с массовой долей основного вещества (100,0±0,2)%; готовят высушиванием при 100 °С до постоянной массы. При необходимости проводят перекристаллизацию (два-три раза) из трехкратного количества воды с перемешиванием во время кристаллизации.
Кислота серная по ГОСТ 4204, растворы молярных концентраций: 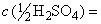 1 моль/дм
1 моль/дм (1 н.); 0,5 моль/дм
(0,5 н.); 0,1 моль/дм
(0,1 н.) или
кислота соляная по ГОСТ 3118, растворы молярных концентраций 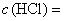 1 моль/дм
1 моль/дм (1 н.); 0,5 моль/дм
(0,5 н.); 0,1 моль/дм
(0,1 н.).
Метиловый оранжевый (индикатор) по ТУ 6-09-5171, раствор с массовой долей 0,1%.
Фенолфталеин (индикатор) по ТУ 6-09-5360, спиртовой раствор с массовой долей 1%.
Смешанный кислотно-основной индикатор (метиловый красный и метиленовый голубой).
Натрия гидроокись по ГОСТ 4328.
Кислота янтарная по ГОСТ 6341, препарат с массовой долей основного вещества (100,0±0,2)%, готовят следующим образом: 100 г препарата растворяют при кипячении в 165 см воды, раствор фильтруют и охлаждают при перемешивании до комнатной температуры, выделившиеся кристаллы отфильтровывают и вторично перекристаллизовывают в тех же условиях, затем высушивают между листами фильтровальной бумаги до тех пор, пока они не перестанут прилипать к стеклянной палочке. Перекристаллизованную янтарную кислоту пересыпают в банку с пришлифованной пробкой и хранят в эксикаторе, наполненном хлоридом кальция, высушенным при 100 °С. В день установления коэффициента поправки навеску помещают в стаканчик для взвешивания и сушат до постоянной массы при температуре (100±5) °С.
Калий гидрофталат (калий фталевокислый кислый).
Спирт этиловый ректификованный технический по ГОСТ 18300.
2.2.2. Приготовление растворов
250 г гидроокиси натрия растворяют в фарфоровом (ГОСТ 9147) или фторопластовом стакане в 250 см воды. После охлаждения раствора до комнатной температуры его переносят в стеклянный или полиэтиленовый сосуд, закрывают резиновой или полиэтиленовой пробкой и в течение 2-3 недель выдерживают до полного осаждения углекислого натрия, не растворимого в растворе гидроокиси натрия указанной концентрации.
В отстоявшемся прозрачном концентрированном растворе устанавливают массовую концентрацию гидроокиси натрия по плотности (с применением таблиц) или титрованием. При титриметрическом определении 1 см раствора, отобранного пипеткой 4(5)-2-1 (ГОСТ 29227), доводят водой до 40 см
и титруют из бюретки (ГОСТ 29251) вместимостью 50 см
раствором серной или соляной кислоты молярной концентрации 1 моль/дм
. 1 см
раствора серной кислоты молярной концентрации точно
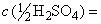 1 моль/дм
1 моль/дм или соляной кислоты молярной концентрации точно
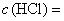 1 моль/дм
1 моль/дм соответствует 0,04 г гидроокиси натрия.
Для приготовления 1 дм раствора гидроокиси натрия берут объемы концентрированного раствора, соответствующие массам гидроокиси натрия в граммах, указанным в табл.4.
Таблица 4
Концентрация раствора |
|
|
|
Масса гидроокиси натрия, г |
40,0 |
20,0 |
4,0 |
Затем объем раствора доводят водой до 1 дм.
Раствор концентрации 1 моль/дм хранят в полиэтиленовой или стеклянной склянке с тубусом и бутылке, парафинированной внутри.
2.1.4-2.2.2. (Измененная редакция, Изм. N 1).
2.2.3. Определение коэффициента поправки
2.2.3.1. Определение коэффициента поправки по соляной или серной кислоте
30-40 см раствора кислоты соответствующей концентрации, отмеренных из бюретки, помещают в коническую колбу, добавляют 3-4 капли раствора смешанного индикатора и титруют из бюретки раствором гидроокиси натрия до перехода красно-фиолетовой окраски раствора в зеленую.
Раствор гидроокиси натрия с коэффициентом поправки, определенным по соляной или серной кислоте, рекомендуется применять при титровании сильных минеральных кислот.
2.2.3.2. Определение коэффициента поправки по йодноватокислому калию (для раствора молярной концентрации 0,1 моль/дм (0,1 н.)
Формула 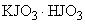 .
.
Относительная молекулярная масса - 389,91.
Молярная масса эквивалента - 389,91 г/моль.
1,2000-1,5000 г кислого йодноватокислого калия помещают в коническую колбу и растворяют в 100 см горячей воды. После охлаждения добавляют 3-4 капли раствора смешанного индикатора и титруют из бюретки раствором гидроокиси натрия до перехода красно-фиолетовой окраски в зеленую.
Раствор гидроокиси натрия с коэффициентом поправки, определенным по кислому йодноватокислому калию, рекомендуется применять при титровании сильных минеральных кислот.
2.2.3.3. Определение коэффициента поправки по янтарной кислоте
Формула 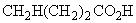 .
.
Относительная молекулярная масса - 118,09.
Молярная масса эквивалента - 59,04 г/моль.
В зависимости от молярной концентрации приготовленного раствора гидроокиси натрия навески янтарной кислоты взвешивают в стаканчике для взвешивания в соответствии с табл.5.
Таблица 5
Молярная концентрация |
|
|
|
Масса янтарной кислоты, г |
2,0000-2,4000 |
1,0000-1,2000 |
0,2000-0,2400 |
Навеску янтарной кислоты помещают в коническую колбу, растворяют в 40 см воды, добавляют 2-3 капли раствора фенолфталеина и титруют из бюретки раствором гидроокиси натрия до появления не исчезающей в течение 50-60 с розовой окраски.
Раствор гидроокиси натрия с коэффициентом поправки, определенным по янтарной кислоте, рекомендуется применять при титровании органических кислот и слабых минеральных кислот.
2.2.3.1-2.2.3.3. (Измененная редакция, Изм. N 1).
2.2.3.4. Допускается определять коэффициент поправки по кислому фталевокислому калию с применением фенолфталеина в качестве индикатора или ГСО 1-го разряда N 2216-81.
(Введен дополнительно, Изм. N 1).